– 수소 불꽃에서 태어난 화학의 문법, 화학의 언어를 다시 쓰다.
물은 오랫동안 ‘쪼갤 수 없는 순수한 원소’로 여겨졌다.
불, 공기, 흙과 함께 세상을 이루는 기본 성분 중 하나로 믿어졌고,
생명의 상징이며 신성한 존재로 여겨졌던 물.
그런데 어느 날, 한 과학자가 물이 '만들어질 수도 있다’는 장면을 목격한다.
그는 타오르는 불꽃 속에서, 작은 물방울 하나를 보고 세계를 의심하기 시작했다.
그의 이름은 앙투안 라부아지에.
그리고 이 이야기는 물에 대한 수천 년의 오해가 무너지는 순간에 관한 기록이다.
1. 수소 불꽃에서 시작된 질문
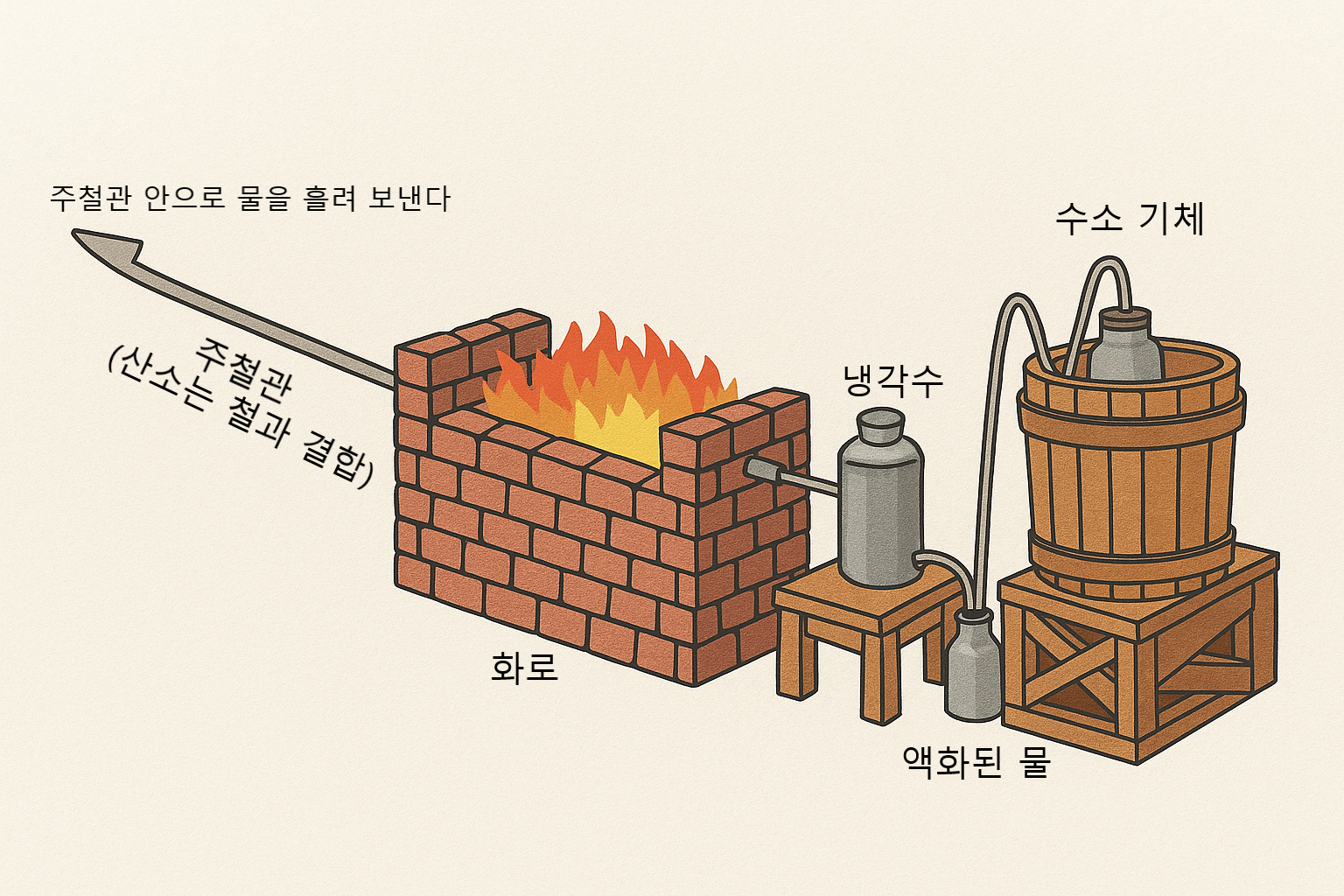
수소는 그 자체로는 가볍고 무색무취한 기체이지만, 불을 붙이면 잘 타오른다.
라부아지에는 수소를 수집한 뒤, 불꽃을 가까이 가져갔다.
그런데 놀라운 일이 벌어졌다.
연소가 일어나는 그 자리에서 물방울이 맺혔다.
그는 즉시 직감한다.
💥 수소는 타면서 그냥 사라지는 것이 아니라,
무언가와 결합해서 물이 되고 있는 것이다.
이것은 단순한 연소가 아니다.
그는 생각한다.
“이 물… 대체 어디서 온 거지?”
“혹시… 이건 수소와 공기 중의 어떤 기체가 결합한 결과가 아닐까?”
“그렇다면, 이 물이라는 존재는 ‘만들어지는’ 것이고, 다시 ‘쪼갤 수 있는’ 것이 아닐까?”
2. 의심을 실험으로 증명하라 – 정량적 측정의 힘
하지만 라부아지에는 단순한 관찰에 머무르지 않았다.
진짜 과학자는 숫자와 저울로 말한다.
그는 수소와 산소가 결합하여 물이 생성되는 현상을 정량적으로 증명하려 했다.
📌 실험 절차:
- 수소와 산소 기체를 다양한 비율로 준비하고, 반응 후 남는 기체의 양을 측정
- 수소가 너무 많으면 → 남음
- 산소가 많아도 → 남음
- 수소와 산소를 정확히 2:1 비율로 혼합했을 때,
남는 기체 없이 완전히 반응하며 물만 생성됨을 반복 실험으로 확인 - 연소 전에 각 기체의 질량을 정밀한 저울로 측정하고
- 생성된 물의 총 질량도 다시 측정
📌 결과:
- 수소 2g + 산소 16g → 물 18g
- 반응 전과 후, 질량의 변화는 0g
- 질량 보존의 법칙이 입증되었고,
- 동시에 물이 수소와 산소의 결합물이라는 사실이 과학적으로 증명되었다
이 ‘2:1’ 비율은 이론에서 유도한 것이 아니라,
수십 번의 정밀한 실험과 측정을 통해 ‘잉여가 없이 완전 반응하는 비율’로 도출된 결과였다.
이후 게이뤼삭, 돌턴, 아보가드로 등의 이론적 설명이 뒤따르며,
이 비율은 화학 반응식의 기본이 된다.
3. 물은 더 이상 원소가 아니다
라부아지에는 이 실험을 통해 선언한다.
“물이란, 수소와 산소라는 원소가 일정한 비율로 결합한 결과물이다.”
“따라서 물은 원소가 아니라, 화합물(compound)이다.”
이 한 문장은 수천 년간 신성시되어 온 ‘물’이라는 존재를 해체했고,
자연 철학의 언어를 화학의 언어로 바꾸는 시작이었다.
4. 전기분해 실험 – 물을 다시 찢다
라부아지에 이후에도 과학자들은 계속 물의 본질을 검증했다.
1800년, 영국의 과학자 윌리엄 니콜슨과 앤서니 칼라일은
갈바니 전지를 이용해 물의 전기분해에 성공한다.
📌 실험 방식:
- 물에 전극을 넣고 전류를 흘려보냄
- 한쪽 전극에서 수소 기체, 다른 쪽 전극에서 산소 기체 발생
- 두 기체의 부피 비율은 2:1
→ 물은 수소 2, 산소 1로 구성된 화합물임을 시각적으로 입증
이 실험은 라부아지에의 주장을 정량적이고 반복 가능한 방식으로 검증했다.
5. 새로운 화학의 문법이 태어나다
라부아지에는 『화학의 기본 원리』에서 물뿐 아니라 모든 물질을
‘원소(element)’와 ‘화합물(compound)’로 구분하는 체계를 제안했다.

이 개념은 이후 화학식, 분자 구조, 주기율표라는 체계로 이어진다.
즉, 라부아지에가 바꾼 것은 단지 물의 정의가 아니라, 화학이라는 학문의 언어 그 자체였다.
🧠 위대한 질문은 작고 사소한 관찰에서 시작된다
불꽃 옆에서 맺힌 작은 물방울.
그것을 보고 대부분의 사람들은 "습기인가?" 하고 지나쳤을 것이다.
하지만 라부아지에는 그 물방울 하나를 통해
물이 만들어지는 현상,
물질의 결합 원리,
자연의 질서 그 자체를 재구성했다.
“과학은 세상을 새롭게 발견하는 것이 아니라,
우리가 본 것을 다시 보게 만드는 것이다.”
– 라부아지에의 정신
📜 라부아지에가 정리한 33가지 원소 (1789)
🔹 1. 기체류 (Gaz)
- 산소 (Oxygène)
- 질소 (Azote)
- 수소 (Hydrogène)
- 탄소 (Charbon)
- 열(열소)* (Calorique)
- 빛(광소)* (Lumière)
*Calorique와 Lumière는 지금은 ‘에너지 개념’이지만, 당시에는 물질로 간주됨
🔹 2. 비금속류 (Substances simples non métalliques)
- 인 (Phosphore)
- 황 (Soufre)
- 염소산염의 기체(염소 개념 없음) → 생략
- 염소? (Muriatic radical)*
- 불소? (Fluoric radical)*
*Radical류는 산의 ‘기’로 추정한 가상의 물질
→ 현대 기준에선 불확정 또는 존재하지 않음
🔹 3. 금속류 (Substances métalliques)
- 은 (Argent)
- 금 (Or)
- 철 (Fer)
- 구리 (Cuivre)
- 납 (Plomb)
- 주석 (Étain)
- 수은 (Mercure)
- 아연 (Zinc)
- 비소 (Arsenic)
- 안티몬 (Antimoine)
- 바륨 (Baryte)*
- 망간 (Manganèse)
- 몰리브덴 (Molybdène)
- 텅스텐 = 볼프람 (Tungstène)*
- 니켈 (Nickel)
- 크롬 (Chrome)
- 코발트 (Cobalt)
*당시 명명이나 분류상 현대 명칭과 혼동되는 것 있음
예: Baryte는 지금의 바륨 화합물 형태
🔹 4. 흙류(Alcalis & Terres)
- 석회(석회질) (Chaux) → 산화칼슘 (CaO)
- 마그네시아(소석회) (Magnésie) → 산화마그네슘 (MgO)
- 실리카(규사) (Silice) → 이산화규소 (SiO₂)
- 알루미나 (Alumine) → 산화알루미늄 (Al₂O₃)
🔹 5. 알칼리 금속류
- 가성 소다 (Soude) → NaOH
(현대: 나트륨 원소는 아직 분리되지 않음)
📌 주의: 당시 개념과 현대 원소 개념의 차이점

📘 의미와 영향
- 최초로 과학적 근거에 기반한 원소 목록을 정리
- 원소와 화합물을 구분하는 사고방식 정립
- 현대 주기율표와 화학 명명법(이온, 산, 염 등)의 기초 철학 마련
🎯 정리 요약

→ 총 33개, 이 중 오늘날 원소로 인정되는 것은 약 23~25개 정도
📌 다음 편 예고
4편 – ‘물: 더 이상 원소가 아닌 존재’
👉 물에 대한 인식의 변화가 과학, 철학, 교육, 사회에 어떤 영향을 미쳤는지 살펴봅니다.
🌊(4편)라부아지에는 어떻게 물 분해 실험을 할 생각을 했을까? [물: 더 이상 원소가 아닌 존재]
– 한 실험이 바꾼 물의 정체성과 인류의 생각“그 물은, 신의 선물이 아니라 인간이 만들어낼 수 있는 것이었다”언제부터였을까.물은 늘 ‘있는 것’이었다.태초의 물, 생명의 물, 4대 원소 중
studygoodjob.com



