반응형
철이 녹스는 것과 산소의 관계는 알겠는데 물은 무슨 관계가 있을까? 쉽게 알아보자.
✅ 1. 공기 중에서 녹스는 원리 (물 없이)
공기 중 산소만으로도 녹이 생길 수 있을까?
부분적으로 Yes, 하지만 느리고 미약합니다.
🌬️ 작동 원리
- 철(Fe)은 공기 중의 산소(O₂)와 반응해 산화철(Fe₂O₃)로 변하려고 합니다.
- 그러나 이 반응은 전자를 주고받는 화학 반응이라, 전해질(이온 이동 경로)이 없으면 잘 진행되지 않습니다.
- 공기 중에는 이온을 운반할 수 있는 매개체(전해질)가 없기 때문에 반응 속도가 매우 느립니다.
- 결과적으로, 아주 오랜 시간이 지나야 표면에 얇은 녹이 생길 수 있습니다.
⚠️ 결론
공기 중 산소만으로는 녹이 거의 생기지 않습니다. 물 또는 습기가 있어야 녹이 제대로 생깁니다.
✅ 2. 물속에서 녹스는 원리 (공기 없어도?)
물이 철을 부식시키는가? 공기 없어도 가능한가?
부분적으로 가능하지만 제한적입니다.
💧 작동 원리
- 물속에는 용해된 산소(O₂)가 어느 정도 녹아 있습니다.
- 철이 물에 닿으면 철의 표면에서 산화(Fe → Fe²⁺)가 시작되고, 용존산소가 이를 환원시킵니다.
- 이때 물(H₂O)은 전해질 역할도 하며, 이온 이동을 가능하게 만들어 전자 흐름이 생깁니다.
- 철은 계속 산화되어 Fe²⁺, Fe³⁺ 이온이 되고, 이 이온은 다시 산소와 결합해 산화철, 즉 녹(Fe₂O₃·xH₂O)이 됩니다.
🔧 전체 반응 흐름: 산화 → 전자 이동 → 환원 → 녹(산화철) 생성
✅ 1단계: 철(Fe)의 산화 반응
철이 전자를 잃고 이온이 되는 과정입니다.
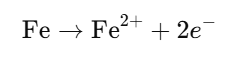
- 산화반응: 철 원자가 전자 2개를 잃고 철(II) 이온이 됩니다.
- 이 전자는 나중에 산소를 환원시키는 데 쓰입니다.
✅ 2단계: 산소의 환원 반응
용해된 산소(O₂)가 수소 이온(H⁺ 또는 물)과 전자를 받아 수산화 이온(OH⁻)이 됩니다.
물이 중성이라면, 일반적인 조건에서는 다음과 같이 진행됩니다:

- 산소(O₂)가 전자 4개를 받아 수산화 이온(OH⁻)으로 바뀝니다.
- 이 반응은 중성 또는 약알칼리성 조건에서 일어납니다.
✅ 3단계: Fe²⁺와 OH⁻의 결합 → 녹 형성의 초기단계
철 이온(Fe²⁺)과 수산화 이온(OH⁻)이 반응해서 수산화철(II) 침전물이 생성됩니다.
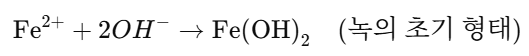
✅ 4단계: 산화가 더 진행 → 녹(붉은색 Fe₂O₃·xH₂O) 생성
수산화철(II)은 공기 중 산소와 수분을 계속 받아 산화철(III) 수화물, 즉 우리가 흔히 아는 붉은색 녹으로 변합니다.

- 이때 생성되는 Fe₂O₃·xH₂O가 바로 붉은색의 녹입니다.
🚫 그런데 만약…
- 공기(산소)가 전혀 없는 물이라면?
→ 이 경우 산화시킬 산소가 없기 때문에 녹이 거의 생기지 않거나 매우 느리게 생깁니다.
✅ 3. 결국 녹이 잘 생기려면?
물과 산소가 동시에 있을 때, 즉 습기 찬 공기, 비 오는 날, 해안가, 물이 고인 철표면 등에서 녹이 가장 잘 생깁니다.

🎯 요약 비교
| 조건 | 녹 발생 여부 | 원리 | 속도 |
| 공기만 있음 | 거의 X | 전해질 없음 → 반응 느림 | 매우 느림 |
| 물만 있음 (산소 없음) | 거의 X | 산화제가 없음 | 매우 느림 |
| 물 + 산소 있음 | ✔ 발생 | 철이 산화되고 산소가 환원됨 → 녹 생성 | 빠름 |
| 물 + 산소 + 전해질 (소금 등) | ✅ 매우 잘 생김 | 염화나트륨 등이 전도도 증가시켜 전자 흐름 원활 | 매우 빠름 |
🧪 덧붙임: 소금물에서 더 잘 녹스는 이유?
- NaCl 같은 소금이 있으면 전해질 역할을 하며 이온 이동이 활발해져 녹이 훨씬 잘 생깁니다.
- 해안가 철 구조물이 쉽게 부식되는 이유가 바로 이것입니다.
'질문이 있는 과학픽' 카테고리의 다른 글
| 철이 녹스는 이유가 철과 산소 사이에 작용하는 힘 때문이라고? (0) | 2025.06.16 |
|---|---|
| 철이 공기(산소) 물 속(용존 산소)에서 더 잘 녹스는 이유 (0) | 2025.06.16 |
| ⚖️(5편)라부아지에는 어떻게 물 분해 실험을 할 생각을 했을까? [질량보존의 법칙:저울 위에서 태어난 과학 법칙] (0) | 2025.06.16 |
| 🌊(4편)라부아지에는 어떻게 물 분해 실험을 할 생각을 했을까? [물: 더 이상 원소가 아닌 존재] (2) | 2025.06.16 |
| ⚗️(3편)라부아지에는 어떻게 물 분해 실험을 할 생각을 했을까? -원소와 화합물 - [화학의 언어를 다시 쓴 사람, 라부아지에] (1) | 2025.06.16 |



